楚福英,王 淼,李元敬,诸 琳,雷 虹,*,冯 磊*
(1.黑龙江大学 农业微生物技术教育部工程研究中心,黑龙江 哈尔滨 150500,2.黑龙江大学生命科学学院,黑龙江省寒地生态修复与资源利用重点实验室,黑龙江 哈尔滨 150080;
3.华南师范大学材料与新能源学院,广东 汕尾 516600;
4.黑龙江省林业科学院科研处,黑龙江 哈尔滨 150081)
机体铁元素摄入量不足或流失过多以及其他造血营养物质的代谢不平衡是导致缺铁性贫血(irondeficiency anemia,IDA)的主要原因[1-2]。IDA是世界上最常见的营养缺乏症,它会影响人体的多个器官脏器,如肝脏、脾脏、结肠等,损害人体生理功能,严重影响人们的健康[3-4]。口服补铁药物是目前治疗IDA的主要方法[5-6]。然而,大多数口服补铁药物副作用大,可能造成肠道损伤,进而影响胃肠道铁元素的吸收[1,7]。因此,寻找更加安全有效的IDA治疗新方法至关重要。
黑木耳(Auricularia auricula)是我国分布广泛且具有独特的营养价值和保健功能的食用菌[8]。传统中医认为黑木耳具有养气补血,治疗气血亏虚的功效,是优质的天然补血品,可以促进机体造血。黑木耳含有多种生物活性化合物,黑色素是其中的主要生物活性成分,其安全性高[9],且具有防辐射、抗肿瘤、抗氧化、提高机体免疫力等作用[10-11],在食品加工、化妆品开发、疾病的预防和治疗等方面具有广阔的应用前景[12]。Wang Furong[13]和Lei[14]等的研究表明鱿鱼墨黑色素铁可作为有效的潜在补铁剂来治疗IDA。
肠道菌群及其产物对宿主的生长发育不可或缺,并且可以对肠道健康产生多方面的影响[15-16],因为肠道菌群不仅能够调节胃肠道中的宿主生理过程,还可调节肠道外器官,如肝脏、大脑和免疫系统[17-19]。研究表明,IDA会使肠道菌群发生紊乱,并且低铁条件被认为是导致微生物组成的重大变化的原因[20]。因此,对IDA动物肠道菌群的深入研究可能是治疗IDA的关键。
本研究通过构建IDA小鼠模型,对模型组小鼠进行黑木耳黑色素灌胃实验,记录各组小鼠的体质量变化,采用血细胞自动分析仪分析小鼠的血常规指标,通过高通量测序技术分析小鼠粪便微生物组成,探究黑木耳黑色素对IDA小鼠生理和肠道菌群的影响。
1.1 动物、材料与试剂
45 只SPF级24 日龄雄性昆明小鼠(体质量(14.0±1.7)g)购买自哈尔滨医科大学实验动物学部,实验动物生产许可证号:SCXK(黑)2019-001,实验动物使用许可证号为:SYXK(黑)2018-003。
黑木耳(菌种保藏编号为CCTCC-HDXZ-1) 东宁黑木耳产业基地;
盐酸、氢氧化钠、无水乙醇、乙酸乙酯、氯仿(均为分析纯) 天津市科密欧化学试剂有限公司;
粪便基因组DNA提取试剂盒 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
Biologiclp粉碎机 飞利浦(珠海)有限公司;
W201数控恒温水浴锅 上海申胜生物科技有限公司;
LD15-2A高速离心机 北京医用离新机厂;
AB104-N分析天平 梅特勒-托利多仪器(上海)有限公司;
101-3A电热鼓风干燥箱 天津市通利信达仪器厂;
1800i血细胞自动分析仪 日本Sysmex XT公司;
N50 NanoDrop超微量分光光度计 广州市康珏贸易有限公司。
1.3 方法
1.3.1 黑木耳黑色素的制备
参考文献[21]并稍作修改,从黑木耳中提取、纯化黑色素。将烘干后的黑木耳经粉碎机粉碎,过80 目筛。取25 g黑木耳粉末样品,加入500 mL 3 mol/L盐酸和1 L蒸馏水,70 ℃下水浴浸提1.0~1.5 h,在浸提液中加入质量分数38.46% NaOH溶液直到有絮状沉淀生成,充分溶解搅拌后,4 000 r/min离心10 min,取上清液,加入12 mol/L盐酸至有黑色絮状物出现,4 000 r/min离心20 min,取沉淀,重复离心(4 000 r/min、20 min)2~3 次得到黑色素粗品。将黑色素粗品纯化[21]后进行冷冻干燥,得到黑木耳黑色素样品。
1.3.2 小鼠建模与分组
参照《保健食品检验与评价技术规范实施手册》[22]中的方法,选取45 只24 日龄昆明种雄性小鼠,适应性饲喂1 周后,随机分为2 组:对照组(15 只小鼠)、模型组(30 只小鼠)。模型组小鼠饲喂低铁饲料、饮用超纯水进行造模,造模2 周后小鼠尾部采血,采用血细胞自动分析仪测定小鼠血液中的血红蛋白(hemoglobin,Hb)质量浓度、红细胞(red blood cell,RBC)计数、红细胞比容(hematocrit,HCT)、平均红细胞体积(mean corpuscular volume,MCV),实验小鼠Hb质量浓度不高于100 g/L即为造模成功。随后将模型组小鼠随机平均分为2 组:IDA组、IDA-M组(黑木耳黑色素治疗组),每组15 只。IDA-M组灌胃200 mg/(kgmb·d)黑木耳黑色素,灌胃体积0.2 mL,IDA组灌胃0.2 mL超纯水,两组均采用低铁饲料继续喂养3 周,期间自由饮用超纯水。造模和干预期间,对照组始终饲喂正常饲料并自由饮用去离子水。为避免外源铁污染,实验采用塑料笼体和非铁质笼盖。自实验开始,每周称量小鼠体质量。
1.3.3 样本采集
最后1 次灌胃后,小鼠禁食不禁水24 h,收集0.5 g小鼠粪便立即装入2 mL冻存管,-80 ℃保存,用于后续小鼠粪便微生物高通量测序分析。实验结束时,采用眼球取血的方法收集小鼠血液,每只小鼠收集40 μL血液,加入360 μL肝素钠生理盐水溶液(50 μL肝素钠注射液(2 mL 1.25万单位)用生理盐水定容至20 mL)用于血常规检测。
1.3.4 血常规指标的测定
采用血细胞自动分析仪检测各组小鼠的血常规指标(Hb质量浓度、RBC计数、白细胞(white blood cell,WBC)计数、血小板(platelet,PLT)计数、HCT、MCV)。
1.3.5 小鼠肠道菌群高通量测序
取0.2 g小鼠粪便样本,使用小鼠粪便基因组DNA提取试剂盒提取总DNA,然后使用NanoDrop超微量分光光度计检测DNA的浓度和纯度,将合格的DNA样本保存于冻存管,经液氮速冻后置于干冰中寄送上海美吉生物医药科技有限公司进行高通量测序。采用Illumina Miseq PE250 /PE300进行16S rDNA测序,比较分析各组粪便菌群门和属水平的组成,对小鼠肠道菌群进行Alpha多样性指数分析和主成分分析(principal component analysis,PCA)。
1.4 数据处理与分析
每组样品重复测定3 次,结果以平均值±标准差表示。数据采用Excel软件进行处理,采用Origin 2019软件作图,采用SPSS 23.0软件进行t检验,比较组间显著性差异,P<0.05和P<0.01分别代表差异显著和差异极显著。
2.1 IDA小鼠模型的建立
饲喂2 周低铁饲料进行IDA造模,造模结果如表1所示,血常规结果表明模型组小鼠的Hb质量浓度降低至(94.30±3.84)g/L。同时,与对照组相比,模型组的RBC计数、HCT分别极显著下降了39.1%、33.8%(P<0.01),MCV显著下降了9.8%(P<0.05)。参照《常用医药研究动物模型》[23]中规定的IDA判断依据:Hb质量浓度不高于100 g/L、RBC计数下降和MCV减小,本研究模型组小鼠表现出了明显的贫血症状,表明本实验造模成功。

表1 缺铁饮食造模结束时各组小鼠外周血液指标结果Table 1 Routine peripheral blood indices of mice fed normal or lowiron diet for two weeks
2.2 黑木耳黑色素对IDA小鼠体质量的影响
给小鼠饲喂低铁饲料,饮用超纯水2 周后,小鼠开始出现萎蔫不振、运动量减少、生长减缓等现象,灌胃黑木耳黑色素可显著改善这一现象。如图1所示,造模结束时模型组小鼠体质量显著低于对照组(P<0.05);
黑色素干预结束时,IDA-M组的体质量极显著高于IDA组(P<0.01),而与对照组无显著差异(P>0.05)。以上结果表明,黑木耳黑色素可以使IDA小鼠体质量恢复正常水平,推测黑木耳色素干预改善了小鼠的消化功能。

图1 黑木耳黑色素对IDA小鼠体质量的影响Fig.1 Effect of A.auricula melanin on body mass of IDA mice
2.3 黑木耳黑色素对IDA小鼠血液指标的影响
IDA可以通过机体血象指标的改变确定,其中主要以Hb质量浓度、RBC计数最能反映机体是否处于IDA及其所处程度[24-25];
另外,MCV和HCT也是诊断贫血的重要指标[26];
WBC计数可以反映机体的免疫功能[27];
PLT可以反映机体的凝血能力[28],以上指标均具有较高的临床诊断评估价值。各组小鼠的血常规结果如图2所示。灌胃黑木耳黑色素3 周后,IDA-M组小鼠的Hb质量浓度、RBC计数、HCT、MCV相对于IDA组分别极显著或显著升高了93.06%(P<0.01)、72.28%(P<0.01)、65.39%(P<0.01)、18.52%(P<0.05),与对照组相应指标的水平相近,说明黑木耳黑色素可使IDA小鼠贫血指标恢复正常,从而改善IDA;
IDA-M组小鼠的WBC计数相对于IDA组显著升高了68.83%(P<0.01),说明黑木耳黑色素可使IDA小鼠WBC数目恢复至正常水平,提高IDA小鼠的免疫力,降低结肠炎症发生的概率;
IDA-M组小鼠的PLT计数相对于IDA组显著降低了32.16%(P<0.05),说明黑木耳黑色素可有效减少IDA小鼠PLT数目,从而降低血液凝固带来的风险。

图2 黑木耳黑色素对IDA小鼠血液指标的影响Fig.2 Effect of A.auricula melanin on blood indices of IDA mice
2.4 黑木耳黑色素对IDA小鼠肠道菌群多样性的影响
宿主与肠道微生物之间存在动态平衡,结肠组织损伤所引起的屏障功能丧失往往伴随着肠道菌群结构的改变,课题组前期研究表明IDA小鼠存在肠道损伤[29],而IDA对肠道菌群的影响鲜有研究。为进一步揭示肠道菌群与IDA的关系,本研究通过高通量测序分析肠道菌群多样性的变化。如图3所示,IDA组小鼠的Shannon、Chao1和Ace指数均极显著低于对照组和IDA-M组(P<0.01);
IDA-M组小鼠的上述指数均恢复至正常水平;
此外,低铁饮食可导致Simpson指数极显著升高(P<0.01),补充黑木耳黑色素极显著缓解了IDA小鼠肠道菌群Simpson指数变化(P<0.01)。表明IDA会导致小鼠肠道菌群多样性降低,补充黑木耳黑色素可显著改善并恢复IDA小鼠肠道菌群多样性。
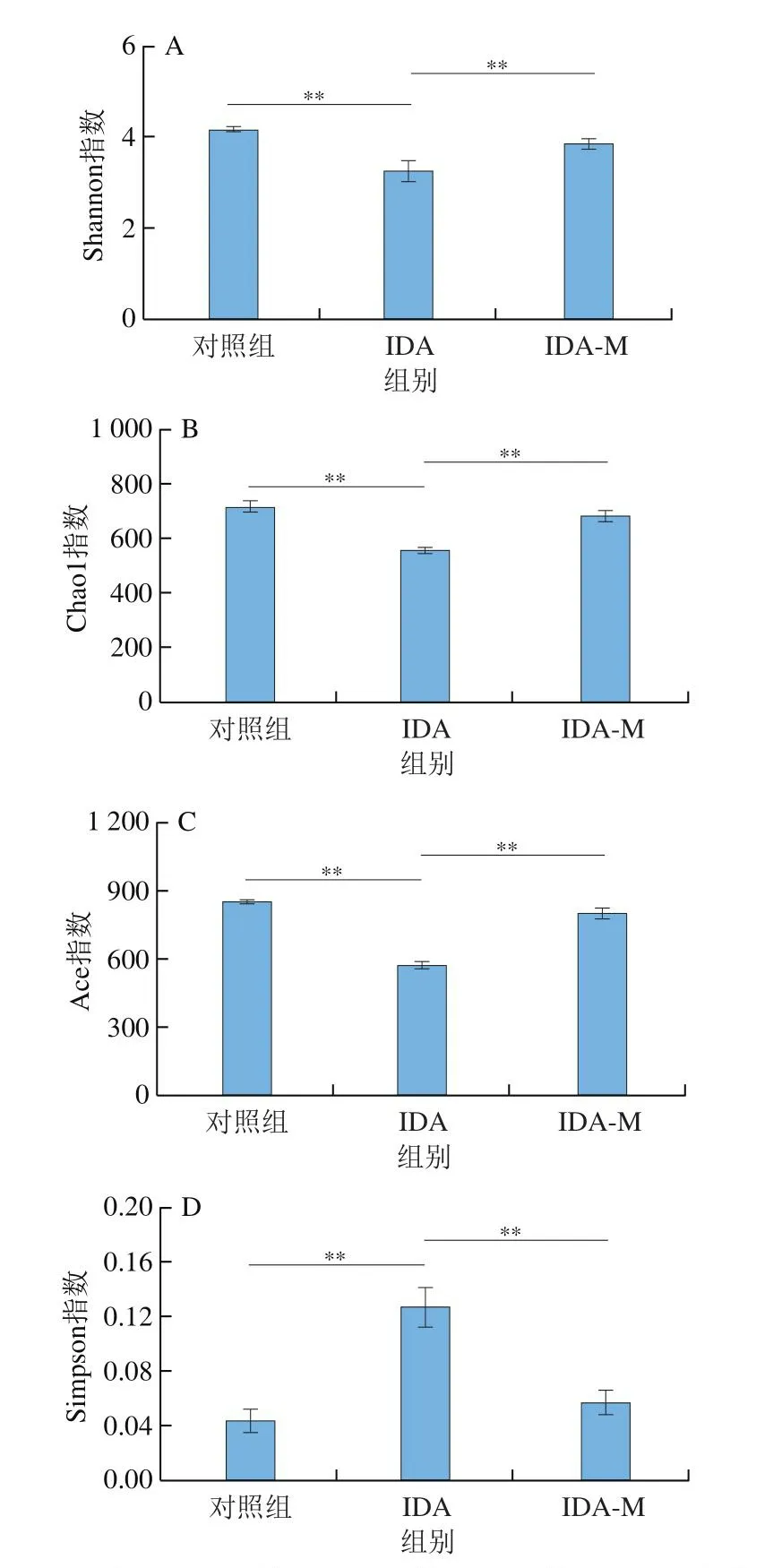
图3 黑木耳黑色素对IDA小鼠肠道菌群Alpha多样性指数的影响Fig.3 Effect of A.auricula melanin on alpha-diversity indices of intestinal flora in IDA mice
为进一步确认黑木耳黑色素改善IDA小鼠肠道菌群失衡的现象,利用PCA和Venn图分析黑木耳黑色素对IDA小鼠肠道菌群的修复作用。如图4A所示,PCA结果表明对照组和IDA-M组位置相近,与IDA组显著分开,说明对照组和IDA-M组的肠道菌群结构相似度较高,且均与IDA组的菌群结构存在明显差异,表明黑木耳黑色素对IDA小鼠肠道菌群结构具有改善作用。Venn图可以用来统计样本中共有和独有的分类操作单元(operational taxonomic unit,OTU)的数目,直观展现出不同环境样品中OTU数目组成相似性及重叠情况[30]。由图4B可知,3 组样本的共有OTU数目有130 种,IDA组独有OTU数目最少,仅174 种,灌胃黑木耳黑色素后独有OTU数目提升至233 种。由此可见,黑木耳黑色素可以增加IDA小鼠肠道菌群的独有OTU数目,增加肠道菌群多样性。

图4 各组小鼠肠道菌群PCA图(A)和Venn图(B)Fig.4 Principal component analysis (PCA) plot (A) and Venn diagram (B)of gut microbiome in mice from three groups
2.5 黑木耳黑色素对IDA小鼠肠道菌群群落组成的影响
IDA是常见的铁营养缺乏性疾病,是世界范围内主要的公共卫生问题之一。研究表明,婴幼儿IDA与肠道菌群有关[20],而且肠道菌群可通过代谢产物增加铁蛋白的表达,以抑制宿主的肠道铁吸收[31],表明肠道菌群或可作为铁失调的治疗靶点。因此IDA的防治需要更加重视肠道菌群的作用。黑木耳黑色素对IDA小鼠肠道菌群组成的影响如图5、6所示。小鼠肠道菌群中门水平的优势菌门分别是拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)和变形菌门(Proteobacteria),占小鼠肠道菌群的99%以上(图5A)。当补充黑木耳黑色素后,IDA-M组的Firmicutes和Verrucomicrobia相对丰度相对于IDA组分别明显增加了29.72%和2 794.12%,Bacteroidetes和Proteobacteria分别明显降低了20.80%和13.03%,与对照组相比已无明显差异。Pereira等[32]研究也表明,Bacteroidetes、Firmicutes、Proteobacteria是补充纳米铁(III)或硫酸亚铁前后IDA小鼠粪便微生物群中的主要菌群。Muleviciene等[20]发现IDA患者会肠道中Bacteroidetes和Proteobacteria富集,Verrucomicrobia相对丰度降低,与本研究结果一致。说明黑木耳黑色素可以缓解由IDA引起的主要优势菌门的变化,并使之恢复至正常水平。

图5 各组小鼠粪便样本中主要门和属水平菌群组成Fig.5 Composition of intestinal flora in three groups of mice at the phyla and genus levels
属水平上相对丰度前10 位菌属为小鼠肠道微生物优势菌属(图5B)。由图6可知,与对照组相比,IDA组小鼠肠道中的Akkermansia、Alistipes、未分类的属、Falsiporphyromonas、Coprobacter相对丰度分别极显著或高度显著降低了97.43%(P<0.001)、54.01%(P<0.01)、59.13%(P<0.01)、91.32%(P<0.001)、98.26%(P<0.01);
条件致病菌Parabacteroides相对丰度极显著增加了433.12%(P<0.01)。补充黑木耳黑色素后,与IDA组相比,IDA-M组小鼠肠道中的Akkermansia、Alistipes、未分类的属、Falsiporphyromonas、Coprobacter相对丰度分别显著增加了3 080.88%(P<0.001)、216.61%(P<0.001)、104.36%(P<0.05)、521.21%(P<0.05)、6 520.00%(P<0.01);
Parabacteroides相对丰度极显著降低了89.57%(P<0.01)。最新的研究表明乳杆菌属可感知肠道中的铁水平,并抑制宿主的铁吸收;
而铁失衡会导致肠道菌群的改变,进而改变微生物多样性,增加病原体相对丰度并诱导肠道炎症的发生发展[31]。


图6 黑木耳黑色素对IDA小鼠肠道属水平差异微生物相对丰度的影响Fig.6 Effect of A.auricula melanin on relative abundance of differential intestinal microorganisms in IDA mice at the genus level
哺乳动物肠道中的Akkermansia属微生物均为嗜黏蛋白阿克曼氏菌(Akkermansia muciniphila),这是一种潜在益生菌[33-34],其相对丰度与炎症水平呈负相关[35-36];
课题组前期的研究也表明IDA可引起小鼠结肠炎症损伤[29],由此推测,与对照组小鼠相比,IDA小鼠Akkermansia muciniphila相对丰度显著降低,而补充黑木耳黑色素后显著提高了小鼠肠道Akkermansia muciniphila的相对丰度,表明Akkermansia muciniphila在黑木耳黑色素改善IDA过程中可能发挥重要作用,而这种作用可能与炎症修复有关。
Alistipes是拟杆菌门的一种革兰氏阴性细菌,主要存在于健康人的肠道中,可代谢产生琥珀酸、乙酸、丙酸等短链脂肪酸,Dostal等[37]研究表明铁缺乏会导致有益菌Alistipes相对丰度减少,与本实验结果相似。先前的研究表明短链脂肪酸具有抗炎作用,由此推测Alistipes相对丰度降低会促使短链脂肪酸含量减少,这也可能是铁缺乏加剧肠道损伤的原因。相反补充黑木耳黑色素显著增加了Alistipes相对丰度,表明其在黑木耳黑色素改善IDA过程中同样具有重要作用。Alistipes是一种从临床样本中分离出来的相对较新的细菌属,尽管Alistipes在健康表型中发挥作用,但需要注意的是,Alistipe可能引起焦虑、抑郁症等疾病[38]。因此,需要进一步有针对性地研究该属在疾病和健康中的作用。
本实验结果表明IDA小鼠Falsiporphyromonas相对丰度高度显著降低(P<0.001),补充黑木耳黑色素改善贫血状况后Falsiporphyromonas相对丰度显著增加(P<0.05)。目前关于Falsiporphyromonas的报道较少,有研究表明其与卟啉单胞菌属基因序列相似度较高[39],且均为紫单胞菌科微生物。卟啉单胞菌是一种绝对需铁菌[40],推测Falsiporphyromonas也具有相似的性质,可以通过Falsiporphyromonas相对丰度水平推测宿主的贫血状况。
Coprobacter菌属可以降解膳食纤维,产生丙酸、丁酸等有益的短链脂肪酸[41],本实验结果表明补充黑木耳黑色素极显著提高了Coprobacter的相对丰度。Parabacteroides是人体核心菌群之一,Noble等[42]研究表明高糖饮食会导致Parabacteroides水平升高,而Parabacteroides水平越高,记忆缺陷则越明显。本实验结果表明缺铁会导致Parabacteroides水平升高,补充黑色素则会显著逆转Parabacteroides的相对丰度,表明该菌在黑色素改善IDA的过程中起到与黑色素相反的作用。然而,Wang Kai等[43]的研究揭示了肠道共生菌Parabacteroides distasonis在调节糖脂代谢方面是一种潜在的新型抗代谢综合征益生菌。因此,需要根据特定条件来判定Parabacteroides是否为致病菌。以上结果表明,补充黑木耳黑色素显著提高有益菌的相对丰度,降低有害菌的相对丰度,表明肠道菌群在参与黑木耳黑色素改善贫血过程中具有重要作用,但其具体作用机制还有待进一步研究。
本实验结果表明黑木耳黑色素可增加IDA小鼠体质量,改善和恢复IDA小鼠贫血症状指标Hb质量浓度、RBC计数、HCT、MCV、WBC计数、PLT计数,增加有益菌Akkermansia、Alistipes等菌属相对丰度,降低条件致病菌Proteobacteria的相对丰度。总之,黑木耳黑色素干预能够恢复和改善IDA症状,肠道菌群可能在其中发挥重要作用,未来研究可以采用菌群剔除、粪菌移植并结合代谢组学技术,进一步分析肠道菌群在黑木耳黑色素治疗IDA中发挥作用的机制。
猜你喜欢黑木耳黑色素菌群“云雀”还是“猫头鹰”可能取决于肠道菌群中老年保健(2022年2期)2022-08-24“水土不服”和肠道菌群科学(2020年4期)2020-11-26啊,头发变白了!阅读与作文(小学低年级版)(2019年12期)2019-12-26德江黑木耳贵茶(2019年3期)2019-12-02Q7.为什么人老了头发会变白?奥秘(创新大赛)(2019年8期)2019-11-30为什么人有不同的肤色?小天使·四年级语数英综合(2019年9期)2019-11-09产胞外黑色素菌株的鉴定及发酵条件优化天然产物研究与开发(2016年11期)2016-06-15七个黑木耳引进品种的比较试验食药用菌(2016年6期)2016-03-01肉牛剩余采食量与瘤胃微生物菌群关系动物营养学报(2015年10期)2015-12-01西藏林芝地区黑木耳袋料栽培技术的探索西藏科技(2015年1期)2015-09-26