姚伦,周雍进
(中国科学院大连化学物理研究所生物技术研究部,辽宁 大连 116023)
人类对化石资源的使用引起了全球变暖和气候变化,进而导致如干旱、洪涝、高温等极端天气以及海平面上升、土壤荒漠化、生物多样性减少等,严重威胁了人类的生存和发展。因此,迫切需要改变对化石资源的依赖。随着生物技术的不断发展,对生物系统进行改造,已经实现利用糖、淀粉、木质纤维素等原料合成各种能源燃料、大宗化学品、材料、药物等产品,能够部分取代目前依赖化石资源的能源和化学品的生产。
第一代生物制造以糖、淀粉等为原料,主要来源于玉米、甘蔗、高粱等,存在“与人争粮、与粮争地”等问题。以燃料乙醇为例,2021 年全球产量达273 亿加仑(1 加仑=3.78541L),主要以玉米(美国)和甘蔗(巴西)为原料生产[1],其中,仅美国就有51.5亿蒲式耳(1.31亿吨)玉米用于燃料乙醇生产,占其全部玉米产量的34%[2]。近期的研究表明,由于美国《可再生燃料标准》的实施,燃料乙醇大量生产,使得玉米价格上涨30%左右,同时带动了其他粮食价格上涨,如大豆、小麦等价格提高20%左右;
此外,玉米的大量需求使得其种植面积增加8.7%,进而带来额外的土地开垦(690 万英亩,1 英亩=4046.864798m2)、化肥的生产和使用、水体污染等,间接导致了额外的CO2排放,使得生物乙醇与传统汽油相比,反而产生更高CO2排放(24%)[3]。
第二代生物制造以木质纤维素为主要原料,包括农作物秸秆、林业废弃物等。木质纤维素主要由纤维素、半纤维素和木质素组成,其结构复杂,需要经过预处理、酶解等过程才能被微生物利用,因此,仍然面临效率低、成本过高的困境[4]。其中,预处理过程(气爆、酸处理、碱处理等)能耗高、成本高,占全部设备成本的30%~50%和运行成本的20%~25%;
此外,预处理过程还容易产生呋喃醛、酸类、酚类等对细胞有毒性的物质,影响后续微生物发酵过程。酶解过程需要大量使用纤维素酶,占全部成本的30%,目前纤维素酶存在稳定性差、寿命短、活性低等缺陷,致使酶解过程效率偏低,成本过高[5]。
一碳化合物(CO2、CO、甲烷、甲醇、甲酸等)来源广泛、生产量大、价格相对低廉,除了以传统化石资源为原料,利用成熟技术大量生产外,也能够利用多种可再生资源制备(图1),是较为理想的新一代生物制造原料。自然界中存在多种能够利用一碳化合物的微生物,对大肠杆菌、酿酒酵母等模式微生物进行改造,也能构建合成型一碳利用微生物,并实现一碳资源到多种产品的转化[6]。因此,基于一碳化合物的生物制造有望实现能源和化学品的绿色、可持续生产,对于实现碳减排、碳达峰和碳中和具有重要意义。

图1 一碳化合物原料来源
一碳化合物有气态(CO2、CO和甲烷)和液态(甲醇和甲酸等)两种类型,自然界和许多工业生产过程均产生大量的一碳气体。其中,CO2资源最为丰富,来源广泛,大气中的CO2体积分数约为0.041%。化石资源的利用过程会释放大量的CO2,这也是造成全球气候变化的主要原因。根据国际能源署(IEA)报告,2021 年全球与能源和工业过程相关的CO2排放量达363 亿吨,达历史最高水平,其中煤炭、石油和天然气导致的CO2排放分别为153 亿吨、107 亿吨和75 亿吨,CO2排放主要来源于电力和供热、钢铁冶炼、交通运输以及建筑等行业[7]。2021年,中国的CO2排放量达119亿吨,是最大的碳排放国[7]。近年来,利用CO2加氢、光催化、电催化等制备还原性一碳化合物(CO、甲烷、甲酸、甲醇)取得快速进展,为CO2的资源化利用和还原性一碳化合物的可持续生产奠定了基础[8]。
CO 和甲烷来源也非常广泛。化石燃料的不完全燃烧、炼钢等工业生产过程均会排放大量的CO。另外,CO 也是合成气的主要成分之一,合成气是重要的化工原料,既可由煤、焦炭等固体燃料气化产生,又可由天然气、煤层气、页岩气和石脑油等轻质烃类制取,还可由重油经部分氧化法生产[9]。甲烷是天然气、沼气的主要成分,也是造成温室效应的第二大气体。国际能源署(IEA)报告显示,2021年全球能源领域的甲烷排放量高达1.35亿吨,甲烷排放主要来源于包括煤炭和油气开采、农业生产、生物质燃烧、垃圾填埋等[10]。生物质作为储量最大的可再生原料,通过气化获得含有CO、CO2、氢气、甲烷等的混合气体[11],可实现一碳气体的可持续供应。
液态一碳原料中,甲醇是重要的基础化工原料,来源稳定,价格相对低廉。甲醇主要以天然气和煤为原料经合成气制备,技术成熟度较高。2020年,全球甲醇产能达到1.27 亿吨,产量约8000 万吨,我国是最大的甲醇生产国,年产量超过6000 万吨[12]。可再生的甲醇制备主要有两条线路:一是以生物质为原料,通过气化然后制备甲醇,潜在的主要原料包括农业和林业废弃物、城市固体废弃物、垃圾填埋场和污水产生的沼气等;
二是利用CO2加氢(可再生能源发电生产的氢气)生产甲醇[13]。其中,中国科学院大连化学物研究所李灿院士团队研发的“液态阳光”技术已完成千吨级绿色甲醇合成示范工程,目前正在开展十万吨级绿色甲醇合成工业示范[14]。甲酸的可持续供应与甲醇类似,除CO2还原外,也可由生物质氧化制备[15−16]。
一碳化合物中,CO2是碳的最高氧化态,而甲烷的还原度最高。微生物细胞中,还原态的一碳化合物(甲烷、甲醇、甲醛、甲酸和CO)均可发生氧化反应,最终生成CO2,为细胞提供能量和还原力。甲烷可发生氧化反应生成甲醇,甲醇发生氧化反应生成中间代谢物甲醛,甲醛可以进入同化途径,包括核酮糖单磷酸途径(ribulose monophosphate pathway,RuMP)、木酮糖单磷酸途径(xylulose monophosphate pathway,XuMP) 和 丝 氨 酸 循 环(serine cycle),也可以进一步被氧化生成甲酸。甲酸再被甲酸脱氢酶(formate dehydrogenase,FDH)彻底氧化生成CO2。CO 能发生氧化反应生成CO2,为细胞提供能量,也可经Wood−Ljungdahl途径进入中心代谢[17]。CO2则经卡尔文循环(Calvin−Benson−Bassham cycle,CBB cycle)等碳固定途径进入中心代谢(图2)。

图2 微生物中一碳化合物代谢途径
2.1 CO2固定
自然界中存在多条CO2固定途径,已经发现了7 条天然CO2固定途径,即卡尔文循环、Wood−Ljungdahl 途 径、 二 羧 酸/4−羟 基 丁 酸 循 环[dicarboxylate/4−hydroxybutyrate (DC/HB) cycle]、3−羟基丙酸/4−羟基丁酸循环[3−hydroxypropionate/4−hydroxybutyrate(HP/HB)cycle]、3−羟基丙酸双循环(3−HP bicycle)、还原三羧酸循环(reductive TCA cycle,rTCA)和还原甘氨酸途径(reductive glycine pathway,rGlyP)[18]。Liu 等[19]对这些途径进行详细的总结和阐述。
卡尔文循环是光能自养微生物、化能自养微生物等多种微生物固定CO2的途径,卡尔文循环可分为三个阶段。① 羧化:核酮糖1,5二磷酸(RuBP)在核酮糖1,5二磷酸羧化酶/加氧酶(Ribulose−1,5−bisphosphate carboxylase/oxygenase, RuBisCO) 的作用下与CO2结合,随后分解为2分子3−磷酸甘油酸。② 还原:3−磷酸甘油酸首先在磷酸甘油激酶催化下被ATP磷酸化形成1,3−二磷酸甘油酸,再由甘油醛磷酸脱氢酶催化被NADPH还原形成3−磷酸甘油醛。③ RuBP的再生:3−磷酸甘油醛经过一系列反应,转变为5−磷酸核酮糖,再由磷酸核酮糖激酶催化进行磷酸化形成RuBP。整个过程需要消耗7个ATP,固定3分子CO2并生成一分子丙酮酸,因此卡尔文循环被认为是能量利用效率最低的碳固定途径[20]。
卡尔文循环中的RuBisCO是决定碳同化速率的关键酶,也是光合作用的主要限速步骤之一,其催化效率较低,催化常数kcat为1~12s−1[21]。RuBisCO既能催化RuBP 与CO2的羧化反应,也能以氧气为底物,使RuBP进入光呼吸途径,消耗光合作用合成的有机物,从而抑制RuBisCO的羧化酶活性[22]。微藻、蓝细菌等光合微生物中存在CO2浓缩机制(CO2concentrating mechanism,CCM),通过在羧酶体内浓缩CO2提高其浓度,从而提高RuBisCO催化CO2羧化反应的效率,减少RuBisCO 加氧酶的活性和光呼吸,进而增加光合作用效率。由于RuBisCO的合成需要复杂的分子伴侣系统协助其折叠和组装,对其进行直接改造提高活性难度较大,目前研究主要集中于挖掘新的更高效的RuBisCO 酶[23−25]。Matsumura 等[26]将水稻中的RuBisCO 小亚基替换为来源于C4植物高粱的RuBisCO 小亚基,得到的杂合型的RuBisCO相较于水稻野生型RuBisCO具有更高的催化速率(kcat),与CO2的亲和力提高,而与氧气的亲和力降低。Lin 等[25]利用来源于不同茄科植物的RuBisCO 构建了其系统进化树,并预测RuBisCO的进化过程和祖先酶,将不同RuBisCO祖先酶在大肠杆菌中表达,筛选得到了具有更优催化特性的RuBisCO。
还原甘氨酸途径是最近在硫酸盐还原菌(Desulfovibrio desulfuricans)中被证实天然存在的CO2固定途径[18],在该途径中,CO2首先被还原生成甲酸,然后经过还原和环化形成5,10−亚甲基四氢叶酸,然后经核心固碳酶甘氨酸裂解体系(glycine cleavage system,GCS)催化与CO2和氨生成甘氨酸,甘氨酸经过甘氨酸还原酶复合体、磷酸乙酰转移酶催化生成乙酰辅酶A,整个过程固定2 分子CO2。还原甘氨酸途径常被用来在模式微生物中构建CO2和甲酸的同化途径[17]。
2.2 CO的氧化和同化
CO氧化首先由关键酶一氧化碳脱氢酶(carbon monoxide dehydrogenase,CODH) 催 化 生 成CO2,为细胞提供能量。CODH 有两种形式:① 单功能酶,催化CO 氧化生成CO2;
② 双功能酶,不仅能够将CO2还原为CO,还参与催化甲基、CO 和辅酶A 生成乙酰辅酶A。CODH 可分为两大类:一类为存在于需氧微生物中的Mo−Fe−黄素CODH,该类酶对氧气不敏感;
另一类为存在于厌氧微生物中的Ni−Fe CODH,对氧气敏感。在这两类金属酶中,位于活性中心起关键作用的金属分别是钼(Mo)和镍(Ni),因此这两类酶分别被称为Mo−CODH和Ni−CODH,而Ni−CODH 的催化活性远高于Mo−CODH[27−28],其中,来源于产氢一氧化碳嗜热菌(Carboxydothermus hydrogenoformans)的ChCODH−Ⅱ是目前报道的催化活性最高的CODH[27],但是由于ChCODH−Ⅱ的氧气敏感性,限制了其实际应用。近期,Kim 等[29]通过将ChCODH−Ⅱ与氧气相对不敏感但催化活性较低的ChCODH−Ⅳ进行结构比较,发现了ChCODH−Ⅱ气体通道的关键氨基酸(A559),对该氨基酸进行突变能够大幅改善ChCODH−Ⅱ的氧气敏感性,而不影响其催化活性。
CO 的同化经由Wood−Ljungdahl 途径完成。该途径又称还原乙酰辅酶A 途径(reductive acetyl−CoA pathway),是产乙酸菌和一些古细菌(如产甲烷菌)的固碳途径,以CO 或者氢气氧化提供能量。Wood–Ljungdahl 途径由甲基分支和羰基分支组成。在甲基分支中,CO2由甲酸脱氢酶催化还原生成甲酸,随后由甲基四氢叶酸合成酶催化生成甲酰四氢叶酸,最后由甲基转移酶将其甲基转移形成甲基类咕啉铁硫蛋白(Methyl−CoFeS);
羰基分支中,以CO为碳源时,CO分子能够被直接同化进入羰基分支,以CO2为碳源时,CO2首先由一氧化碳脱氢酶/乙酰辅酶A合成酶复合体(CODH/ACS)催化形成CO。最后在CODH/ACS催化下,甲基基团、羰基基团和辅酶A共同合成乙酰辅酶A[30]。
2.3 甲烷代谢
甲烷的代谢过程首先由甲烷单加氧化酶(methane monooxygenase,MMO)催化氧化生成甲醇。甲烷单加氧化酶包括两种类型,即存在于细胞质中的可溶性甲烷单加氧化酶(soluble MMO,sMMO)以及与膜结合、颗粒状的甲烷单加氧化酶(particulate MMO,pMMO)。sMMO由3个蛋白组成,即羟化酶(hydroxylase,MMOH)、还原酶(reductase,MMOR)和调节蛋白(regulatory protein,MMOB),其中羟化酶MMOH 负责甲烷的氧化。颗粒状的甲烷单加氧化酶由三个亚基组成(pmoB、pmoA 和pmoC),该酶依赖铜离子发挥活性,对甲烷具有更强的亲和性[31]。甲烷氧化生成甲醇后,再被甲醇氧化酶(methanol dehydrogenases,MDH)氧化生成甲醛,然后通过RuMP途径或丝氨酸循环被同化进入中心代谢。
2.4 甲醇代谢
甲醇代谢起始于其氧化生成甲醛,该反应由甲醇脱氢酶/醇氧化酶(MDH/AOX)催化,是甲醇代谢的关键酶。目前已发现三类甲醇脱氢酶/氧化酶:① 吡咯喹啉醌(PQQ)依赖的甲醇脱氢酶(MDH),该酶依赖细胞色素c介导电子传递;
② 烟酰胺腺嘌呤二核苷酸(NAD+)依赖的甲醇脱氢酶;
③氧依赖的醇氧化酶(AOX)[32]。前两者存在于甲醇细菌和甲烷氧化菌中,氧依赖的AOX 则存在于甲醇酵母中,AOX 氧化甲醇生成甲醛和过氧化氢,过氧化氢再被细胞中的过氧化氢酶分解生成水和氧气。甲醇酵母的甲醇氧化过程在过氧化物酶体中完成,因此能够一定程度上降低甲醛和过氧化氢的细胞毒性[33]。在这三类MDH中,NAD+依赖的MDH应用最为广泛,甲醇氧化得到的电子能够储存于NADH,可直接用于后续产物合成,然而,该类MDH 酶对甲醇的亲和性较低[34]。Wu 等[35]对来源于钩虫贪铜菌(Cupriavidus necator)的甲醇脱氢酶进行定点饱和突变和高通量筛选,获得了对甲醇亲和性大幅度提高的MDH,其催化甲醇氧化的kcat/Km值提高了6倍。Roth等[36]利用甲醛响应系统开发了噬菌体辅助的非连续进化技术,利用该技术对甲醇芽孢杆菌的甲醇脱氢酶(MDH2)进行定向进化和筛选,使酶的最大反应速率Vmax提高3.5倍。
甲醛可进入异化途径或同化途径。在异化途径中,甲醛首先被甲醛脱氢酶(formaldehyde dehydrogenase,FADH)氧化成甲酸,进而被甲酸脱氢酶彻底氧化生成CO2。甲醛同化途径则使其进入中心代谢,甲基营养微生物中主要有三条同化途径:存在于酵母中的XuMP途径,以及存在于细菌中的RuMP 途径和丝氨酸循环。XuMP 途径中,甲醛首先由二羟丙酮合酶(dihydroxyacetone synthase,DAS)催化后与5−磷酸木酮糖缩合生成3−磷酸甘油醛和二羟丙酮。二羟丙酮进一步被二羟丙酮激酶(DAK)催化磷酸化生成磷酸二羟丙酮,最后经由1,6−二磷酸果糖和6−磷酸果糖生成3−磷酸甘油醛和5−磷酸木酮糖[33]。
RuMP 途径可分为固定、水解和重排三个过程。在固定过程中,甲醛与5−磷酸核酮糖在3−己酮糖−6−磷酸合酶的催化下缩合形成6−磷酸己酮糖;
水解过程由磷酸果糖激酶(PFK)催化6−磷酸果糖形成1,6−二磷酸果糖,进而分解形成3−磷酸甘油醛和磷酸二羟丙酮;
在重排过程中,6−磷酸果糖和磷酸丙糖重新形成5−磷酸核酮糖,用于后续甲醛同化[37]。
在丝氨酸循环途径中,甲醛可通过两条途径进入丝氨酸循环。在第一条途径中,甲醛直接与四氢叶酸结合形成亚甲基四氢叶酸;
在第二条途径中,甲醛首先经一系列反应生成甲酸,然后再形成亚甲基四氢叶酸。亚甲基四氢叶酸再与甘氨酸缩合形成丝氨酸,该步骤由丝氨酸羟甲基转移酶(serine hydroxymethyltransferase)催化。丝氨酸经过多步反应生成乙醛酸和乙酰辅酶A,乙醛酸则用于甘氨酸再生,而乙酰辅酶A通过乙基丙二酰辅酶A途径被细胞利用。
2.5 甲酸代谢
甲酸的异化途径由甲酸脱氢酶催化甲酸氧化生成CO2,为细胞提供还原力。甲酸的同化需要对其进行还原,甲酸首先与四氢叶酸形成甲酰基四氢叶酸,该反应由甲酸四氢叶酸连接酶催化,同时需要消耗ATP,然后甲酰基四氢叶酸被还原生成亚甲基四氢叶酸,然后可进入丝氨酸循环、Wood−Ljungdahl 途径和还原甘氨酸途径。亚甲基四氢叶酸也可进一步被分解,生成甲醛,然后经过XuMP和RuMP被同化进入中心代谢[38]。
自然界中广泛存在能够天然利用一碳化合物的微生物,对这些利用微生物进行改造,已经实现利用各种一碳化合物为原料合成多种燃料和化学品,Jiang等[17]已对相关代谢工程改造策略进行了详细的总结和讨论。各种一碳化合物利用微生物、代表物种、宿主特性、遗传操作和产物合成等见表1。
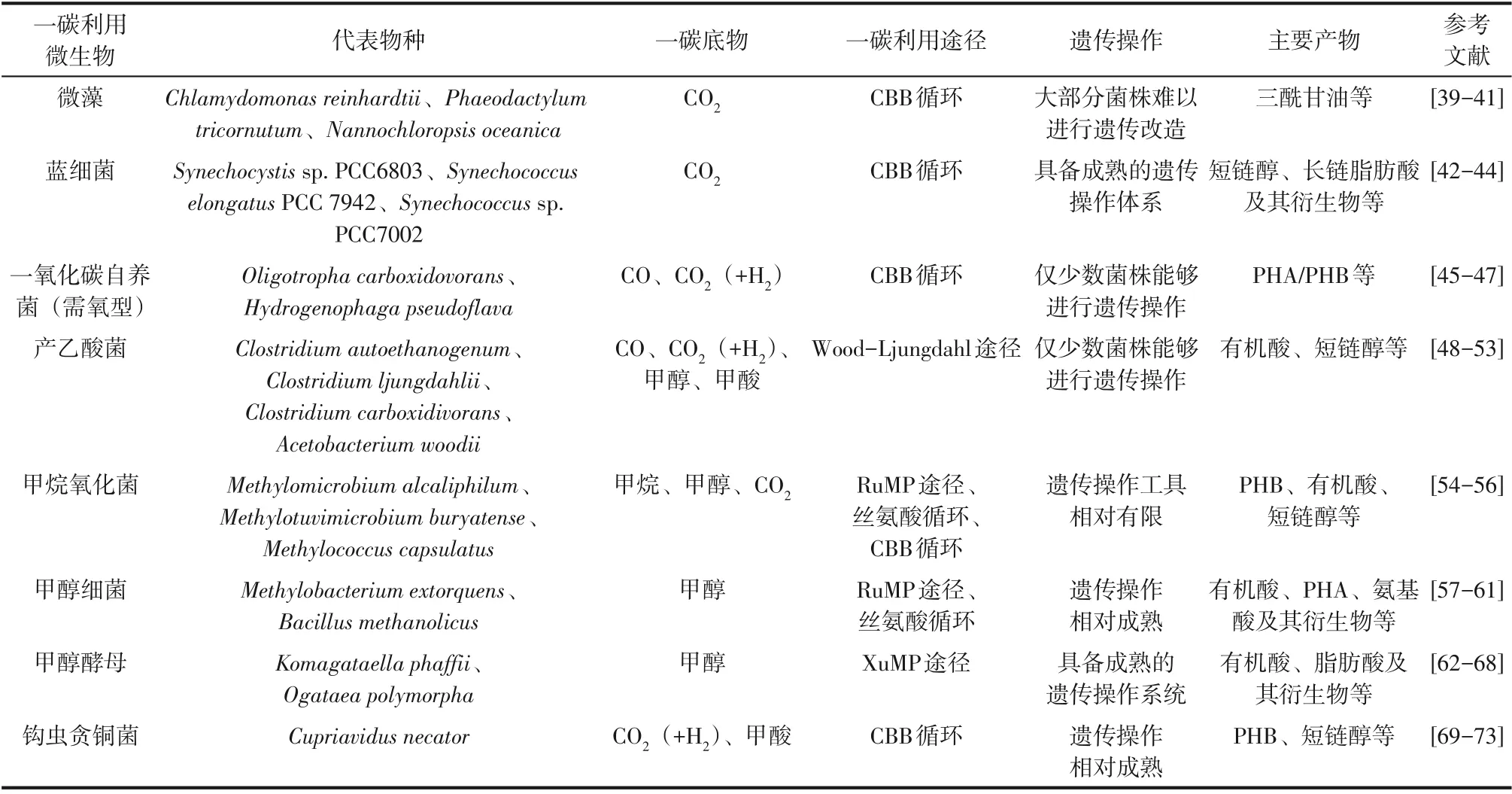
表1 一碳利用微生物及相关产物合成
3.1 CO2
CO2的生物利用首先需要进行固碳,由于CO2是碳的最高氧化态,因此CO2的固定均需要能量输入。不同的微生物利用不同的能量来源进行CO2固定。微藻、蓝细菌等光能自养微生物利用光能通过光合作用进行CO2固定,化能无机自养微生物通过氧化还原态的无机物如氢、CO、铵盐、亚硝酸、硫、硫化氢等提供能量进行CO2固定。
植物、微藻和蓝细菌等光能自养生物能够通过光合作用利用光能,生成NADPH 和ATP,通过卡尔文循环固定CO2,并合成各种糖类等有机物,是地球最主要的碳固定者,为地球生态系统提供能量和物质基础。许多微藻如小球藻(Chlorella)、隐甲藻(Crypthecodinium)、筒柱藻(Cylindrotheca)等能够在细胞中积累三酰甘油(triacylglycerides,TAGs),通常占细胞干重的20%~50%,最高可达80%[39],尤其在缺氮、缺磷、缺硫、高盐等胁迫条件下,细胞中的三酰甘油会大量积累,可用于合成生物柴油[40]。目前,大部分微藻缺乏成熟的遗传操作工具,改造相对困难,只有少数微藻能够进行遗传操作,如莱茵衣藻(Chlamydomonas reinhardtii)、三角褐指藻(Phaeodactylum tricornutum)、微拟球藻(Nannochloropsis)等[41]。
蓝细菌是能够进行光合作用的原核微生物,由于其结构简单,遗传改造相对容易,成为热门的光合微生物底盘细胞,用于构建光合细胞工厂。典型菌株如集胞藻PCC6803(Synechocystissp. PCC6803)、聚球藻PCC7942(Synechococcus elongatusPCC7942)、聚球藻PCC7002(Synechococcussp. PCC7002)等,均具有相对清晰的遗传背景和成熟的遗传操作工具[42]。对蓝细菌的代谢途径进行改造,已实现了利用光能和CO2直接合成多种能源和化学品,如乙醇、乙烯、丁醇、异丁醇、长链脂肪酸和脂肪醇等[43−44]。
利用光能自养微生物合成生物基产品普遍面临能量转化效率有限的难题,研究表明,光合作用系统中光能到生物质的理论最高能量利用效率为8%~10%,实际效率则低于3%[74]。多种因素限制了光合作用的能量利用效率,例如光合作用系统只吸收波长400~700nm 的太阳光,仅占太阳光总能量的45%,因此可对叶绿素进行改造,拓宽光合作用的有效利用光谱,使其具有更高的太阳能捕获效率[75]。
钩虫贪铜菌(C.necator,又称Ralstonia eutropha)能够分别以氢气和CO2为能源和碳源进行生长,通过卡尔文循环固定CO2,此外C.necator也能利用甲酸或有机碳为碳源和能源生长,因此属于兼性化能无机自养微生物。C. necator利用氢气与CO2的混合气生长时氢气的氧化依赖细胞中的氢化酶(hydrogenase),以氧气或硝酸盐为电子受体,C. necator中也发现了类似于藻类细胞中的CCM 相关的酶,能够提高细胞中CO2浓度,供RuBisCO进行碳固定[69]。
C.necator能够在细胞中天然积累大量PHB,最高可达细胞干重的80%[70],因此,可用于生产可降解塑料。该菌株具备相对成熟的遗传操作体系[71−72]。通过引入外源合成途径,同时敲除细胞内源PHB 合成途径,能够将碳源引入其他化合物的合成,如异丙醇(最高产量达9.8g/L)[73,76]、异丁醇、异戊二烯类化合物[77],糖类[78−79]和脂肪酸及其衍生物等[80−81]。C. necator也被用于微生物电合成系统的构建,利用体外电子实现CO2的固定和转化,模拟光合作用系统,该人工光合作用系统理论能量利用效率可达18%,实际效率达10%(利用纯CO2),以大气浓度的CO2培养时能量利用效率可达3%~4%[71]。
3.2 CO
自然界存在多种能够利用CO 的微生物,包括许多细菌和古菌,这些微生物被称作一氧化碳自养菌(carboxydotrophs)。根据CO 代谢时电子受体的不同,可以分为需氧和厌氧两种类型。需氧的一氧化碳自养菌其CO 氧化以氧气为最终电子受体。厌氧型一氧化碳自养菌种类繁多,包括产乙酸菌、产甲烷菌和硫酸盐还原菌等,厌氧的CO 代谢能够产生多种燃料分子和化学品,如氢气、甲烷、乙醇和多种有机酸等,有很大的潜在应用价值。一氧化碳自养菌也能够利用合成生长,对合成气的利用没有严格的气体纯度和成分比例的要求,且能耐受气体中其他污染物,因此一氧化碳自养菌在处理工业(水泥生产、火力发电、炼钢冶炼等)废气(含有CO、CO2、氢气等)用于合成燃料和化学品方面具有应用前景。
需氧的一氧化碳自养菌通过氧化CO提供能量,利用卡尔文循环固定CO2,也能以氢气氧化为细胞提供能量,用于CO2固定。这类微生物遗传操作工具相对匮乏[45],目前,仅有少数菌株实现了遗传改造[46−47]。代表菌株食羧寡养菌(Oligotropha carboxidovorans)和类黄色氢嗜菌(Hydrogenophaga pseudoflava)是被研究最为广泛的两株需氧型一氧化碳自养菌。食羧寡养菌属兼性化能无机自养微生物(chemolithoautotrophic),除了能够以CO 为唯一碳源和能源生长,也能以氢气和CO2的混合气生长,此外,还能利用乙酸、乳酸、丙酮酸等进行异养生长。自养生长时生长速率较低,倍增时间较长,以CO为碳源和能源时倍增时间约20h,以氢气和CO2为能源和碳源倍增时间约7h[82],利用合成气时倍增时间为40~50h[47]。近期,Siebert 等[45]建立了食羧寡养菌稳定的转化、基因敲除、基因表达等遗传操作系统,为该菌的后续研究和改造奠定了基础。类黄色氢嗜菌是另外一株被广泛研究的需氧型一氧化碳自养菌,其以CO 为唯一碳源和能源生长时倍增时间约12h,利用氢气和CO2培养时倍增时间约7h,该菌株已被成功进行代谢工程改造,利用合成气合成α−红没药烯[46]。
产乙酸菌(acetogens)是被广泛研究的厌氧CO利用微生物,除CO外,产乙酸菌还能利用合成气、氢气和CO2的混合气体、甲醇、甲酸、乙醇等进行生长。产乙酸菌通过Wood−Ljungdahl 途径进行碳固定,能够利用一碳化合物天然合成乙醇、乙酸、乳酸、丁醇、2,3−丁二醇等,具有良好的工业应用前景。其中,以一碳气体为原料,利用野生型产乙醇梭菌(Clostridium autoethanogenum,C. autoethanogenum)生产乙酸、乙醇和2,3−丁二醇已实现工业规模生产[48]。以不同碳源为原料进行发酵时,产乙酸菌能够合成不同的产物,例如Eubacterium limosum在一碳气体(H2/CO2/CO)为碳源和能源发酵时,主要产物为乙酸,而不合成丁酸;
当以甲醇为碳源发酵时,能够大量积累丁酸[53],显示产乙酸菌具有很强的代谢可塑性。
厌氧梭状芽孢杆菌(Clostridium,又称食气梭菌)是产乙酸细菌中的重要类群,代表菌株包括永达尔梭菌(C. ljungdahlii)、产乙醇梭菌、食一氧化碳梭菌(C.carboxidivorans)等,是目前合成气发酵中研究最多的菌株,具有重要的工业应用价值。另外,伍氏醋酸杆菌(Acetobacterium woodii,A. woodii)也是产乙酸菌的模式菌株,被广泛研究。目前,大部分产乙酸菌都缺乏成熟稳定的遗传操作工具,少数能够进行遗传改造的菌株包括C. ljungdahlii、C. autoethanogenum、A. woodii等。近年来,启动子、核糖体结合位点、复制质粒、CRISPR 系统、DNA 转化、同源重组系统等逐渐被开发和完善,为后续产乙酸菌的研究和改造提供了便利[49]。除乙酸、乙醇等天然合成的产物外,通过对产乙酸菌进行代谢工程改造,成功合成了其他多种能源和化学品。通过引入丙酮合成途径,在C. ljungdahlii和A. woodii实现了以一碳气体为原料丙酮的合成[50,83];
通过构建PHB的合成途径,实现了在Clostridium coskatii中PHB的合成[84];
在产乙酸菌中构建的其他产物合成途径包括乳酸[52]、丁酸[51]、异戊二烯和甲羟戊酸等[85]。
3.3 甲烷
甲烷氧化菌(methanotroph)能以甲烷为唯一碳源和能源生长,包括好氧甲烷氧化菌和厌氧甲烷氧化菌,在自然界中广泛分布。好氧甲烷氧化菌以氧气为电子受体进行甲烷氧化,厌氧甲烷氧化菌以硫酸盐、硝酸盐、亚硝酸盐以及金属离子(Fe3+、Mn4+)等为电子受体氧化甲烷[86]。相关研究主要集中在好氧甲烷氧化菌,根据碳同化途径的不同,可以将好氧甲烷氧化菌分为三类:第Ⅰ类通过核酮糖单磷酸途径对甲烷进行碳同化,属于γ变形菌;
第Ⅱ类通过丝氨酸循环对甲烷进行碳同化,属于α变形菌;
第Ⅲ类主要由嗜热、嗜酸菌组成,通过卡尔文循环固定CO2实现碳同化,属于疣微菌门[86]。
目前,关于甲烷氧化菌代谢途径的研究和利用主要集中在第Ⅰ类和第Ⅱ类甲烷氧化菌。甲烷氧化菌能够天然利用甲烷积累多种化合物,如PHB、四氢嘧啶、谷氨酸、糖类、脂类等,另外利用甲烷氧化菌以廉价的甲烷或沼气为原料生产单细胞蛋白也一直被广泛研究[54]。通过代谢工程改造,也在甲烷氧化菌中实现了多种其他化合物的合成,包括短链有机酸(乳酸、3−羟基丙酸、丁烯酸、琥珀酸)、长链脂肪酸、醇类(异丁醇、2,3−丁二醇、1,4−丁二醇)、萜类(异戊二烯、柠檬烯、法呢烯、虾青素)等[54−55]。
利用甲烷氧化菌合成甲醇也受到广泛关注。甲醇是甲烷氧化的直接产物,通过抑制甲醇脱氢酶(MDH)可实现甲醇的积累。Xin 等[87]发现当培养体系中存在CO2时,甲烷氧化菌Methylosinus trichosporiumIMV 3011 能够通过分解体内积累的PHB提供能量,用于固定CO2生成甲醇。由于沼气中含有一定量的CO2,以沼气为原料进行甲烷氧化菌发酵也能实现甲醇的积累,研究还发现,沼气中的CO2对于MDH 有抑制作用,因此有助于中间产物甲醇的积累[88]。
3.4 甲醇
自然界中存在多种能够以甲醇为唯一碳源和能源的微生物,包括原核的甲醇细菌(扭脱甲基杆菌、甲醇芽孢杆菌等)和真核的甲醇酵母(巴斯德毕赤酵母、多形汉逊酵母、博伊丁假丝酵母等),广泛分布于废水、土壤和植物表面。由于甲醇是甲烷代谢的中间产物,因此甲烷氧化菌也能够利用甲醇为底物生长。
扭脱甲基杆菌(Methylobacterium extorquens)是目前研究最为详细的甲醇细菌,属于兼性甲基营养菌,不仅能以还原性的一碳化合物(甲醇、甲胺等)为底物生长,也能以乙酸、琥珀酸等二碳和多碳化合物为底物生长[57,89]。扭脱甲基杆菌利用PQQ 依赖型的甲醇脱氢酶氧化甲醇,其甲醇氧化过程位于细胞周质空间。细胞中含有两类甲醇脱氢酶,一类为依赖钙离子的甲醇脱氢酶(MxaFI),另一类为近年来发现的依赖镧系金属的甲醇脱氢酶(XoxF)[90]。甲醇芽孢杆菌(Bacillus methanolicus)是另一株被广泛研究的嗜热甲醇细菌,最适生长温度为50~53℃[58]。甲醇芽孢杆菌通过RuMP 进行一碳固定,具有优良的氨基酸合成能力,野生型菌株MGA3在以甲醇为碳源条件下,能够积累0.4g/L 的L−赖氨酸、12g/L的L−丙氨酸和60g/L的L−谷氨酸[91]。
甲醇细菌尤其是在模式菌扭脱甲基杆菌中,已建立了相对成熟的遗传操作体系,包括基因表达、基因敲除、转座子突变以及基于CRISPR/Cas9的基因编辑和基因调控等工具[59−60,92−94],为甲醇细菌的深入研究和开发利用奠定了基础。通过代谢工程改造,已在甲醇细菌中实现了甲醇到多种能源和化学品的生物转化,包括聚羟基脂肪酸酯类化合物(PHAs)、氨基酸及其衍生物、有机酸类化合物以及各种精细化学品等[61,95]。
甲醇酵母的甲醇代谢位于过氧化物酶体,能够区隔中间代谢物甲醛和过氧化氢,降低其细胞毒性。巴斯德毕赤酵母(Komagataella phaffii,又名Pichia pastoris)和多形汉逊酵母(Ogataea polymorpha)是两株代表性菌株,除甲醇外,还能利用葡萄糖和甘油等多种碳源。两株甲醇酵母中均建立了相对完善的基因表达、同源重组、CRISPR/Cas9基因敲除等遗传操作体系[62−63,66,68]。利用甲醇酵母为宿主,通过代谢工程改造实现了利用甲醇合成乳酸和苹果酸等小分子有机酸以及长链脂肪酸及其衍生物等[64−65,67,96−98],相关综述已在这方面作了详细的总结和阐述[99]。
3.5 甲酸
甲酸的微生物利用分为需氧和厌氧两种类型。在需氧的甲酸代谢中,甲酸被氧化生成CO2,为细胞提供能量并用于CO2固定。C. necator除了能利用氢气和CO2的混合气体生长外,也能以甲酸为唯一碳源和能源生长,是研究最多的甲酸利用微生物之一,其甲酸代谢以氧气为电子受体。C. necator利用相对耗能的CBB循环进行CO2固定,所以以甲酸为碳源和能源进行细胞培养和产物合成时得率较低。Claassens 等[100]尝试通过将C. necator中的碳固定途径由卡尔文循环替换为更高效的还原甘氨酸途径,最终以甲酸为碳源生长时细胞生物量得率接近野生型菌株,虽然没有检测到生物量得率的进一步提高,但是为后续改造提供了思路。
厌氧的甲酸利用微生物主要为产乙酸菌,这些产乙酸菌能够直接同化甲酸进入Wood−Ljungdahl途径最终生成乙酰−CoA。除甲酸外,甲醇也能通过该途径被直接同化,而不经过中间代谢物甲醛。近期,Moon 等[101]挖掘了模式产乙酸菌A. woodii甲酸利用的关键酶(甲酰基−四氢叶酸合酶和甲酸转运蛋白),这两个基因的敲除使细胞甲酸利用速率大幅降低。该作者又详细研究了A. woodii的甲酸利用特性,结果显示,利用甲酸培养时,细胞会大量积累乙酸,而以氢气和CO2培养时,细胞会暂时积累甲酸,然后又被重新利用,而甲酰基−四氢叶酸合酶和甲酸转运蛋白的双敲除突变体无法重新利用前期积累的甲酸。
与模式微生物相比,能够天然利用一碳化合物的微生物遗传背景不够清晰,缺乏完善的合成生物学工具,许多菌株难以进行遗传操作(如大部分微藻、产乙酸菌等),因此利用模式微生物如大肠杆菌、酿酒酵母等为宿主,通过引入一碳化合物代谢途径,构建合成型一碳化合物利用微生物成为近年来的研究热点。其中,大肠杆菌是最常用的宿主,通过分别构建卡尔文循环、还原甘氨酸途径、POAP 循环、FORCE 途径、RuMP 途径、丝氨酸循环等,使得大肠杆菌能够同化CO2、甲酸、甲醇等多种碳源。在酿酒酵母、解脂耶氏酵母和谷氨酸棒杆菌中分别引入甲醇代谢途径(XuMP 途径、RuMP 途径),使得这些微生物具备了甲醇同化能力(表2)。

表2 合成型一碳化合物利用体系
合成型一碳化合物利用微生物虽然具备一定的一碳化合物同化能力,然而,这些微生物普遍面临一碳化合物利用速率慢、异源一碳代谢途径与宿主内生代谢途径不匹配等问题,导致菌株无法生长或生长缓慢。因此,在菌株构建时,除了理性设计和代谢模型辅助设计合成型一碳利用途径外,适应性进化也是解决合成型一碳化合物利用菌株生长缓慢的有效途径。Gleizer等[102]通过在大肠杆菌中引入卡尔文循环和甲酸氧化途径,尝试构建以甲酸氧化提供能量固定CO2的自养型大肠杆菌,然而初期得到的菌株以甲酸和CO2培养时无法生长,该作者通过数月的适应性进化,成功得到了能够自养生长的菌株,进一步研究表明,进化后的菌株在糖代谢、氨基酸合成、核苷酸合成和脂类合成等许多途径发生突变,说明细胞代谢网络需要建立新的平衡才能有效利用一碳底物。
另外,构建体外酶催化体系也是实现一碳底物有效利用和转化的途径之一。体外酶催化体系易于控制,能够避免活细胞内复杂的调控网络,克服活细胞代谢和生长易受毒副产物抑制等难题,具有催化专一性高、副产物少、便于后续产物分离纯化等优点,因此在一碳化合物利用和转化方面越来越受到重视。最近,马延和研究员团队[134]通过多酶催化体系的模块化组装,利用C1模块(甲醛合成)、C3模块(3−磷酸甘油醛合成)、C6模块(葡萄糖6−磷酸合成)和Cn模块(淀粉合成),构建了高效合成淀粉的多酶催化系统,结合CO2人工甲醇合成,实现了以CO2为原料人工合成淀粉的重大突破,其效率可达到植物天然淀粉合成途径的8.5 倍。然而,体外酶催化体系需要克服酶的高效和低成本分离纯化、提高酶的稳定性、辅因子高效再生等难题。
一碳化合物作为下一代生物制造原料,其高效转化和利用对于推动低碳、绿色、可持续的发展具有重要意义,也是实现“碳达峰、碳中和”目标的重要途径之一。虽然一碳化合物生物利用和转化的相关研究正取得快速进展,并已实现微生物和体外酶催化系统利用一碳原料合成多种能源燃料、大宗化学品和精细化学品,然而一碳化合物的生物转化涉及代谢途径设计、菌株构建、过程优化等多方面内容仍然面临诸多难题有待解决,需要进一步开展研究。
(1)一碳化合物利用微生物的遗传背景、一碳代谢途径及其调控等普遍缺乏深入了解,缺乏高效的合成生物学工具,限制了一碳化合物利用微生物开发和利用。
(2)关键酶的筛选与改造,一碳化合物代谢的许多关键酶催化效率偏低,需要挖掘新的高催化活性的酶,或者对已有的酶进行改造,RuBisCO、一氧化碳脱氢酶、甲醇脱氢酶等的筛选和改造为这方面研究提供了思路[35−36,135]。
(3)CO、甲酸等一碳化合物还原度低,其氧化提供的能量有限,导致生物转化时得率低,可通过与其他高还原度的化合物(甲烷、氢气等)共培养,利用这些化合物的氧化提供额外电子。
(4)一碳气体水溶解度低,培养时传质效率低,是气体发酵的限速步骤,因此需要对相关气体反应器进行优化设计[136]。
猜你喜欢脱氢酶甲酸乙酸乙醇和乙酸常见考点例忻中学生数理化·高一版(2022年4期)2022-05-09基于甲酸的硝酸亚铈微波脱硝前驱体的制备核化学与放射化学(2022年2期)2022-04-28传说中的快速解酒方法有效吗?家庭科学·新健康(2021年5期)2021-06-21人11β-羟基类固醇脱氢酶基因克隆与表达的实验研究心肺血管病杂志(2018年11期)2018-12-18甲酸治螨好处多中国蜂业(2018年4期)2018-05-09DMAC水溶液乙酸吸附分离过程浙江大学学报(工学版)(2016年9期)2016-06-05甲酸盐钻井液完井液及其应用之研究当代化工研究(2016年6期)2016-03-20乙酸仲丁酯的催化合成及分析当代化工研究(2016年5期)2016-03-20乙醇脱氢酶的克隆表达及酶活优化中国医药生物技术(2015年4期)2015-12-26创伤性失血性休克大鼠血浆乳酸脱氢酶的动态测定及价值现代检验医学杂志(2015年5期)2015-02-06